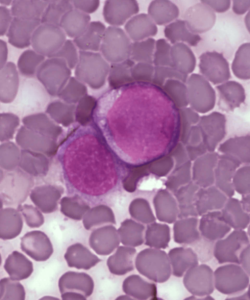
La LLA (también llamada leucemia linfocítica aguda) es un tipo agresivo de leucemia que se caracteriza por la presencia de un elevado número de linfoblastos o linfocitos en la médula ósea y en la sangre periférica. Se puede diseminar a los ganglios linfáticos, el bazo, el hígado, el sistema nervioso central y otros órganos. Los signos y síntomas que puede incluir esta enfermedad son: debilidad o fatiga, fiebre o sudores nocturnos, sangrado de encías, manchas purpúreas en la piel o petequias, falta de aliento, pérdida de peso inesperada o anorexia, dolor en los huesos o articulaciones, inflamación de los ganglios linfáticos (particularmente en el cuello, la axila o la ingle) que generalmente son indoloros, inflamación o malestar en el abdomen e infecciones frecuentes.
La LLA puede afectar tanto a niños como a adultos. Es el cáncer más común diagnosticado en niños, cuyo pronóstico es optimista a diferencia de la población adulta afectada. Esta enfermedad representa aproximadamente el 25% de los diagnósticos de cáncer entre los niños menores de 15 años. En Estados Unidos, se produce a una tasa anual de aproximadamente 41 casos por 1 millón de personas de edad comprendida entre 0 y 14 años y aproximadamente 17 casos por 1 millón de personas entre 15 y 19 años. Por otro lado, la incidencia y mortalidad de adultos con LLA en Estados Unidos en 2019 es de 5.930 nuevos casos y 1.500 muertes.
Existen distintas formas de clasificar las LLA. La más antigua es la realizada por un grupo de franceses, estadounidenses y británicos (FAB) expertos en leucemia que dividieron la LLA en tres subtipos: L1, L2 y L3. La que se utiliza en la actualidad distingue a las LLA según el estadio madurativo de sus linfoblastos y tiene implicaciones pronósticas. La aparición de los anticuerpos monoclonales y las mejoras que se han realizado en las técnicas de citometría de flujo y de reacción en cadena de la polimerasa han permitido clasificar las LLA en distintos tipos:
- LLA de células B
- LLA pre-B temprana (también llamada LLA pro-B)
- LLA común
- LLA pre-B
- LLA de células B maduras (leucemia de Burkitt)
- LLA de células T
- LLA pre-T
- LLA de células T maduras
- Leucemias agudas de linaje mixto: Un pequeño número de leucemias agudas tienen características tanto linfocíticas como mieloides.
La Leucemia Linfoblástica aguda de células T (LLA-T) constituye el 15% de los casos de LLA. Se caracteriza porque las células involucradas tienden a ser precursores de los linfocitos T y producen en sangre periférica células denominadas L2. Células de tamaño intermedio, con núcleo escotado o redondo y cromatina blástica. En la LLA las células precursoras de los linfocitos T expresan en la superficie celular los marcadores CD2, CD3, CD5, CD7 y TdT.
El mayor avance en el tratamiento de la LLA que se está produciendo en la actualidad son las CAR T-cells (chimeric antigen receptor-modified T-cells), con especificidad para CD19. Inmunoterapia basada en terapia celular donde se realiza una reprogramación genética de las propias células T del enfermo para luchar contra el cáncer. Las células CAR-T son linfocitos T del paciente a los que, tras realizar una aféresis al mismo, se les induce para expresar en su superficie un receptor de antígeno quimérico que incluye un anticuerpo anti CD19 unido a un dominio de señal intracelular en el linfocito T. Además, tienen un dominio co-estimulatorio CD28. Una vez que los linfocitos se infunden al paciente, este dominio co-estimulatorio activa al linfocito T para que ataque a las células leucémicas CD19+ y las lise.
‘Kymriah’ (tisagenlecleucel, anteriormente CTL019) ha sido la primera terapia celular CAR-T autorizada por la Agencia de Alimentos y Medicamentos de Estados Unidos (FDA). Se trata de un tratamiento innovador de administración única en pacientes pediátricos y adultos jóvenes hasta 25 años con LLA de células B refractaria. Este tratamiento utiliza las propias células T del paciente para combatir el cáncer y es la única terapia CAR de células T (CAR-T) con receptor de antígeno quimérico que recibió la aprobación en la UE para la LLA de células B refractaria, en recaída tras trasplante o en una segunda o posterior recaída, así como para el tratamiento de pacientes adultos con linfoma B difuso de célula grande (LBDCG) en recaída o refractario (r/r) después de dos o más líneas de tratamiento sistémico.
Esta autorización se ha basado en la revisión del ensayo clínico de registro CAR-T llamado “ELIANA”, entre otros. El ensayo clínico “ELIANA” es un ensayo abierto, multicéntrico, de fase II, de un solo brazo, para determinar la eficacia y seguridad de CTL019 en pacientes pediátricos con LLA de células B r/r. El objetivo primario es valorar la eficacia del tratamiento con CTL019 medida por la tasa de remisión global (que incluye remisión completa y remisión completa con recuperación incompleta del hemograma) durante los 3 meses posteriores a su administración. Consta de las siguientes fases secuenciales: Detección, Pretratamiento (Preparación del Producto Celular y Quimioterapia), Tratamiento y Seguimiento Primario, Seguimiento Secundario (si procede) y Seguimiento de la Supervivencia. La duración total del estudio es de 5 años a partir de la perfusión celular CTL019 y actualmente se encuentra activo con el periodo de reclutamiento finalizado. La fecha de fin para la recopilación de datos para valorar el objetivo primario se estima para el 28 de noviembre de 2022 y no se dispone hasta el momento de resultados al respecto.
Imagen: Linfocitos T (derivada de Blausen.com staff (2014). «Medical gallery of Blausen Medical 2014». WikiJournal of Medicine 1 (2). DOI:10.15347/wjm/2014.010. ISSN 2002-4436. – Own work, CC BY 3.0).
Por otro lado, se ha realizado un estudio global de fase 2, de una sola cohorte, con tisagenlecleucel en pacientes pediátricos y adultos jóvenes con LLA de células B r/r. Este estudio se ha llevado a cabo en 25 centros de estudio en 11 países de América del Norte, Europa, Asia y Australia y el objetivo principal ha sido la tasa de remisión general (la tasa de remisión completa o remisión completa con recuperación hematológica incompleta) durante los 3 meses posteriores al tratamiento. Para este análisis se han evaluado 75 pacientes que han recibido una perfusión de tisagenlecleucel. Los resultados fueron que la tasa global de remisión en un plazo de 3 meses fue del 81%, y todos los pacientes que tuvieron una respuesta al tratamiento fueron negativos para la enfermedad residual mínima, según se evaluó mediante citometría de flujo. Las tasas de supervivencia libre de eventos y supervivencia global fueron del 73% (intervalo de confianza del 95%, 60 a 82) y 90% (IC del 95%, 81 a 95), respectivamente, a los 6 meses y del 50% (IC del 95%, 35 a 64) y 76% (IC del 95%, 63 a 86) a los 12 meses. Se observó persistencia de tisagenlecleucel en la sangre durante 20 meses y los acontecimientos adversos de grado 3 o 4 que se sospechaba que estaban relacionados con la medicación de estudio ocurrieron en el 73% de los pacientes. El síndrome de liberación de citoquinas se produjo en el 77% de los pacientes, 48% de los cuales recibieron tocilizumab. Los acontecimientos neurológicos ocurrieron en el 40% de los casos y se trataron con atención de apoyo, y no se notificó ningún edema cerebral. La conclusión fue que una sola perfusión de tisagenlecleucel proporcionó una remisión duradera con persistencia a largo plazo, con efectos tóxicos transitorios de alto grado.
Es importante remarcar que la terapia con células CAR-T tiene una serie de limitaciones. Entre ellas está la toxicidad que puede producir la terapia, las comorbilidades que pueda presentar el paciente y las características del tumor, que se describen a continuación.
Este tipo de terapia puede producir efectos secundarios como cualquier tratamiento contra el cáncer y uno de los más frecuentes es el síndrome de liberación de citocinas (SLC). Las células T liberan de forma rápida y masiva citoquinas en el torrente sanguíneo para estimular y dirigir la respuesta inmunitaria, lo que puede ocasionar fiebres muy altas y bajadas rápidas de la tensión arterial. No obstante, este síndrome puede controlarse con terapias convencionales de apoyo incluyendo esteroides.
La aplasia de las células B es otro posible efecto secundario y consiste en la muerte en masa de estas células. En las células B normales también se expresa el antígeno de superficie celular CD19 y son también destruidas a menudo por las células T y CAR. Para compensarlo se utiliza terapia de inmunoglobulina para proveer los anticuerpos necesarios para combatir las infecciones.
Otro efecto secundario grave y posiblemente fatal es la inflamación del cerebro, o edema cerebral que lleva a la suspensión del tratamiento. Sin embargo este problema parece ser limitado y no se da en todos los pacientes que reciben este tipo de terapia. Otras neurotoxicidades son la confusión y actividad convulsiva, pero en la mayoría de casos son de corta duración y reversibles.
La presencia de comorbilidades también limita el tratamiento con células CAR-T. Entre estas comorbilidades se encontrarían presentar antecedentes de trombosis venosa profunda o padecer insuficiencia cardiaca crónica, trastorno neurológico, insuficiencia renal y esteatosis hepática, entre otros.
Las limitaciones basadas en las características del tumor serían presentar una masa tumoral elevada, enfermedad hiperprofilerativa, riesgo de infiltración a órganos vitales y afectación del Sistema Nervioso Central.
A modo de conclusión se puede confirmar que ‘Kymriah’ (tisagenlecleucel) ha demostrado unos índices de respuesta sólidos y duraderos, así como un perfil de seguridad consistente para esta población de pacientes difíciles de tratar. De este modo, se puede hablar de la terapia genética con células CAR-T como una terapia con potencial curativo para aquellos pacientes jóvenes con LLA que no han sido tratados favorablemente con las terapias existentes y a los que les quedan opciones limitadas.
Referencias:
Adult Acute Lymphoblastic Leukemia Treatment (PDQ®). Health Professional Version. PDQ Adult Treatment Editorial Board. Published online: February 8, 2019. https://www.ncbi.nlm.nih.gov/books/NBK65727/#CDR0000062864__1
Childhood Acute Lymphoblastic Leukemia Treatment (PDQ®). Health Professional Version. PDQ Pediatric Treatment Editorial Board. Published online: April 30, 2019. https://www.ncbi.nlm.nih.gov/books/NBK65763/#CDR0000062923__1
Determine Efficacy and Safety of CTL019 in Pediatric Patients With Relapsed and Refractory B-cell ALL (ELIANA). NCT Number: 02435849. Sponsor: Novartis Pharmaceuticals. https://clinicaltrials.gov/ct2/show/record/NCT02435849?term=eliana&rank=1
Lassaletta Atienza A. Leucemias. Leucemia linfoblástica aguda. Pediatr Integral 2016; XX (6): 380 – 389
Maude SL, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018 Feb 1;378(5):439-448. doi: 10.1056/NEJMoa1709866.


