Genética Médica News
El mecanismo que promueve la metástasis es un proceso normal que aprovecha el cáncer para propagarse
- octubre 26, 2022
La proteína NALCN regula la metástasis
Amparo Tolosa, Genotipia
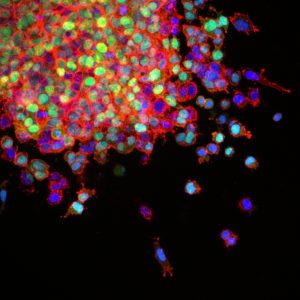
La proteína NALCN con función de canal de calcio regula la metástasis y la diseminación de las células normales desde sus tejidos a otras partes del cuerpo, revela un reciente estudio con ratones dirigido por investigadores de la Universidad de Cambridge. El trabajo no solo ofrece una potencial nueva diana terapéutica frente a la metástasis, principal causa de muerte por cáncer, sino que presenta la separación de las células de un tejido como un proceso normal, no exclusivo del cáncer.
La metástasis o propagación de un cáncer de un tejido a otras partes del cuerpo es la principal causa de muerte en los pacientes con cáncer. Hasta el momento se pensaba que la capacidad de separarse del tejido original y colonizar otros tejidos, era una característica ventajosa que las células cancerosas adquirían durante el proceso tumoral. No obstante, un reciente trabajo realizado con ratones, plantea que se trata de un mecanismo independiente del cáncer, que puede ocurrir en células normales y que está regulado por la proteína NALCN.
“Estamos increíblemente emocionados de haber identificado una única proteína que regula no solo cómo se propaga el cáncer por el organismo, independientemente del crecimiento del tumor, sino también la separación y reparación del tejido normal”, indica Eric Rahrmann, investigador en el Instituto Cambridge de Investigación del Cáncer de Reino Unido y codirector del trabajo. “Ahora podemos considerar si hay fármacos ya existentes que puedan ser redirigidos a prevenir este mecanismo y la diseminación del cáncer en pacientes”.
Un canal de sodio que regula la separación de las células de un tejido
NALCN codifica para una proteína con función de canal de sodio que mantiene la diferencia basal en la concentración de iones en el interior y exterior de las células (el potencial de membrana). Su actividad es esencial en tejidos que requieren cambios en este potencial de membrana, como el tejido nervioso o la respiración. No obstante, hasta el momento, se desconocía qué función podía tener en otro tipo de tejidos.
La presencia de alteraciones en el gen en ciertos tumores y el patrón de mutaciones que presentan estos tumores, similar al que se observa en tumores con alteraciones en el conocido gen supresor de tumores TP53, hizo pensar inicialmente a los investigadores que NALCN podría tratarse de un gen supresor de tumores como TP53. Partiendo de esta premisa, decidieron evaluar qué ocurre al eliminar la función del gen en el contexto del cáncer y en controles.
Al inactivar genética o farmacológicamente el gen Nalcn en ratones modelo de diferentes tipos de cáncer (gástrico, intestinal y pancreático) los investigadores observaron un aumento en la metástasis y el número de células tumorales circulantes liberadas del tejido con cáncer.
Y, lo más inesperado, en el caso de animales sin cáncer o mutaciones relacionadas, la inactivación del gen producía un efecto similar a la metástasis en tejidos sanos. En este caso, células epiteliales de diferentes tejidos se separaban de su entorno original (como hacen las células tumorales circulantes) y podían viajar a otros órganos, donde eran capaces de formar estructuras normales.
Implicaciones en el conocimiento sobre el cáncer y el desarrollo de terapias
Los resultados del trabajo indican que el mecanismo que induce la metástasis puede ocurrir de forma independiente al desarrollo tumoral. Se trataría por lo tanto de un proceso normal del que se aprovechan los tumores para propagarse por el organismo y generar nuevos tumores secundarios.
El trabajo también ofrece una vía para el desarrollo de terapias que permitan frenar la metástasis. Los investigadores plantean que manipular la función de NALCN a través de fármacos que puedan mantener abierto el canal podría ser una estrategia efectiva, ya utilizada para regular otros canales implicados en enfermedades, como ocurre en el caso de la fibrosis quística.
De momento, el proceso regulado por NALCN se ha observado en modelos de ratón y estudios futuros deberán demostrar que también ocurre en humanos. “No solo hemos identificado uno de los elusivos mecanismos que conducen la metástasis sino que hemos dado la vuelta a una creencia común, mostrando cómo el cáncer secuestra procesos de las células sanas en su propio beneficio”, ha señalado Richard Gilbertson, Director del Instituto Cambridge de Investigación del Cáncer de Reino Unido y codirector del trabajo. “Si se valida en nuevas investigaciones esto podría tener implicaciones de largo alcance en cómo prevenimos la diseminación del cáncer y podría permitirnos manipular este proceso para reparar órganos dañados”.
Otra implicación derivada del trabajo afecta a la utilización del gadolinio como contraste en las pruebas de pacientes con cáncer. Hasta ahora se sabía que este metal pesado, que utilizan los investigadores en el trabajo para bloquear farmacológicamente NALCN, puede aumentar el riesgo de fibrosis sistémica. El nuevo trabajo plantea que al actuar sobre NALCN, el gadolinio utilizado en las pruebas de imagen podría acelerar la metástasis, cuestión que también deberá ser evaluada en estudios futuros.
Artículo científico: Rahrmann, E.P., Shorthouse, D., Jassim, A. et al. The NALCN channel regulates metastasis and nonmalignant cell dissemination. Nat Genet. 2022. https://doi.org/10.1038/s41588-022-01182-0
Fuente: Breakthrough in understanding of how cancer spreads could lead to better treatments. https://www.cam.ac.uk/research/news/breakthrough-in-understanding-of-how-cancer-spreads-could-lead-to-better-treatments
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos y formación universitaria, así como nuestro canal audiovisual, Genotipia TV.
Categorías
- Actualidad
- Congresos
- Coronavirus
- CRISPR
- Debates
- Diagnóstico Genético
- Enfermedades Raras
- Entrevistas
- Envejecimiento y longevidad
- Epigenética
- Farmacogenética
- Formación
- Genética del cáncer
- Genética en Cardiología
- Medicina Reproductiva
- Microbiología molecular
- Neurociencia
- Noticias de Genotipia
- Noticias de investigación
- Noticias patrocinadas
- Proyectos
- Reseñas de libros
- Terapia Génica
- Tratamientos
Cursos relacionados
Contacto
¿Quieres publicar con nosotros? ¿Tienes dudas?
Contacta con nosotros de la manera que prefieras y te responderemos a la mayor brevedad.





