Apenas 6 años después de que se inventara la edición del genoma mediante editores de bases, está aproximación ha sido utilizada para tratar un paciente con leucemia linfoblástica aguda de células T. El pasado mayo Alyssa, una paciente británica de 13 años cuyas opciones de tratamiento se habían agotado, fue la primera persona en recibir linfocitos modificados con editores de bases para tratar esta enfermedad. En la actualidad, se encuentra en remisión.
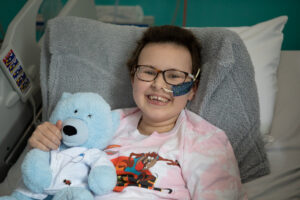
Alyssa fue diagnosticada con leucemia linfoblástica aguda de células T en 2021. Inicialmente, fue tratada con las terapias disponibles para esta enfermedad. Sin embargo, las diferentes aproximaciones, entre las que se incluían quimioterapia y trasplante de médula ósea, no funcionaron y volvió la enfermedad . Agotadas las opciones convencionales, Alyssa se convirtió en la primera paciente en ser reclutada en un ensayo clínico del Instituto Great Ormond Street de Salud Infantil del University College of London para pacientes que han sufrido una recaída de la enfermedad y ya no responden al tratamiento.
El 4 de mayo de 2022 Alyssa recibió un trasplante de células T de un donante sano modificadas genéticamente mediante editores de bases para atacar y eliminar las células tumorales responsables de su leucemia. 28 días después, tras no detectar células tumorales Alyssa recibió un trasplante de médula ósea (en este caso de células normales, sin modificar) para restaurar su sistema inmunitario. Ahora, seis meses tras el trasplante, la paciente se mantiene en remisión y se encuentra en seguimiento.
“La historia de Alysa es una demostración magnífica de cómo con equipos expertos e infraestructura podemos unir las tecnologías más avanzadas en el laboratorio con resultados reales para los pacientes en el hospital”, ha señalado Waseem Qasim, catedrático de Terapia Celular y Genética en el Instituto Great Ormond Street de Salud Infantil del University College of London y consultor en el Great Ormond Street Hospital que lleva años trabajando en el desarrollo de tratamientos CAR-T y ha dirigido el ensayo. “Es nuestro diseño de células más sofisticado hasta ahora y sienta las bases para otros tratamientos y en última instancia, mejores futuros para los niños enfermos”, indica el investigador.
Un nuevo nivel para las terapias CAR-T
El objetivo del ensayo clínico era evaluar un tipo de linfocitos o células T modificados para reconocer y atacar las células T tumorales responsables de la leucemia linfoblástica aguda de células T resistente a tratamiento. Esta enfermedad es poco frecuente y las opciones terapéuticas son limitadas.
La aproximación seleccionada por los investigadores es muy similar a la de las conocidas terapias CAR-T, que están obteniendo resultados positivos en pacientes con leucemia linfoblástica de células B difícil de tratar. En esencia consiste en aprovechar la habilidad natural de las células T para activar el sistema inmunitario y potenciarla para atacar y eliminar a las células tumorales.
En el caso de las terapias CAR-T para leucemias linfoblásticas de células B, las células T se modifican para actuar frente a las células B, de forma que eliminan tanto células B malignas como sanas. El problema en el caso de las leucemias linfoblásticas de células T es que las células a modificar y las células a eliminar son del mismo tipo, por lo que las células modificadas no solo atacan a las células T malignas y normales, sino que también se atacan entre ellas. Para evitar este conflicto, los investigadores diseñaron un nuevo tipo de célula T, en el que introdujeron los siguientes cuatro cambios:
- Inactivación del gen del receptor de células T (TCR), que permite reconocer antígenos de forma específica y participa en la activación de las células T en respuesta a antígenos. Al eliminar estos receptores, los investigadores convierten a las células T modificadas en células T universales.
- Inactivación del gen CD7, que codifica para una proteína localizada en la membrana de los linfocitos T. Al eliminar la producción de esta proteína los linfocitos modificados no podrían identificarse entre sí como diana. Es decir, esta modificación los hace invisibles para ellos mismos.
- Inactivación del gen CD52, que codifica para una proteína utilizada a menudo como diana de diversos fármacos antitumorales. Con su eliminación en los linfocitos modificados, los investigadores los hacen resistentes a fármacos que serán utilizados en el paciente.
- Adición de un receptor quimérico de antígenos (receptor CAR) que reconoce el receptor CD7 de las células tumorales. Con esta modificación las células T pueden identificar y atacar las células leucémicas.
El resultado final de las modificaciones realizadas es un cultivo de células T, universales y resistentes a fármacos, que reconocen y atacan a las células T tumorales pero no se reconocen a ellas mismas como células T (y por lo tanto no se atacan entre sí).
Editores de bases para obtener células T que actúan frente a las células T tumorales
Para inactivar los genes TCR, CD7 y CD52, los investigadores recurrieron al sistema de edición génica conocido como editores de bases. Esta aproximación tiene como ventajas que permite modificar un único nucleótido del ADN forma específica sin romper la cadena de ADN. Por lo tanto ofrece múltiples posibilidades de edición como corrección de errores genéticos o inactivación, con un menor riesgo de que se produzcan cambios no deseados. Por ejemplo, para inactivar el gen CD7 los investigadores diseñaron un editor de bases que modifica una citosina de una posición determinada del gen en una timina, lo que introduce un codón de parada que evita la producción de CD7.
Estrategias previas de modificación de células T han utilizado el sistema CRISPR/Cas9 clásico o TALENS. Esta última estrategia se utilizó hace unos años para tratar con éxito a una paciente de apenas un año diagnosticada de leucemia linfoblástica aguda sin alternativa terapéutica.
Una terapia que abre el camino para tratar otras enfermedades
Alyssa es la primera persona en recibir una terapia basada en editores de bases que ha tratado con éxito su enfermedad. Antes del tratamiento, los cuidados paliativos eran su única opción alternativa. Ahora la joven británica se encuentra en remisión, aunque su salud deberá ser monitorizada durante un tiempo.
Los resultados del caso de Alyssa, ejemplo de cómo se trasladan los avances científicos a la clínica, se han presentado en el Congreso Anual de la Sociedad Americana de Hematología. En la actualidad, el ensayo clínico mantiene su reclutamiento abierto para otros pacientes infantiles de sus mismas características. Además, los resultados del trabajo, abren nuevas vías de desarrollo de terapias basadas en editores de bases para otras enfermedades.
“Estamos encantados de escuchar los resultados prometedores de este tratamiento y la esperanza que ha proporcionado para Alyssa y su familia”, ha indicado Louise Jones, Directora de Traslación en el Medical Research Council (MRC), institución que ha financiado el proyecto. “Las terapias avanzadas (medicinas basadas en genes, tejidos o células) tienen el potencial de transformar las vidas de aquellos con enfermedades difíciles de tratar y se mantienen como una prioridad para el MRC”. Jones destaca que, si los resultados se replica, la terapia celular universal utilizada marcará un importante paso hacia adelante en este tipo de terapias, proporcionando beneficios transformadores para más pacientes”.
Fuentes:
Abstract sobre los editores de bases en terapia celular para la leucemia linfoblástica aguda de células T: 2001 Tvt CAR7: Phase 1 Clinical Trial of Base-Edited “Universal” CAR7 T Cells for Paediatric Relapsed/Refractory T-ALL. https://ash.confex.com/ash/2022/webprogram/Paper169114.html
Ensayo clínico. https://www.clinicaltrials.gov/ct2/show/NCT05397184
GOSH patient receives world-first treatment for her ‘incurable’ T-cell leukaemia. https://www.gosh.nhs.uk/news/gosh-patient-receives-world-first-treatment-for-her-incurable-t-cell-leukaemia/
World-first use of base-edited CAR T-cells to treat resistant leukaemia. https://www.ucl.ac.uk/news/2022/dec/world-first-use-base-edited-car-t-cells-treat-resistant-leukaemia
Primer artículo sobre editores de bases: Komor AC, Kim YB, Packer MS, Zuris JA, Liu DR. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature. 2016 May 19;533(7603):420-4. doi: http://dx.doi.org/10.1038/nature17946
Si te gusta esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos, como el de Introducción a la Terapia Génica y Edición del Genoma, y formación universitaria.

