Amparo Tolosa, Genotipia
Un estudio internacional publicado en Science Translational Medicine ofrece una aproximación para reducir el riesgo a producir una respuesta inmunitaria por parte de las terapias génicas con virus adenoasociados. Los investigadores han conseguido ocultar el genoma viral al sistema inmunitario, impidiendo una activación frente a la terapia que podría comprometer la efectividad del tratamiento y la salud de los pacientes.
La terapia génica, que consiste en utilizar instrucciones genéticas como tratamiento, se presenta como una oportunidad terapéutica muy prometedora para numerosas enfermedades genéticas. Uno de sus múltiples retos es desarrollar vectores que transporten esas instrucciones a las células o al tejido diana más adecuados para tratar la enfermedad.
Los virus adenoasociados han adquirido gran interés como vectores para las terapias génicas, debido a que no son patogénicos para los pacientes y pueden dirigirse a diferentes tejidos. Sin embargo, la respuesta del sistema inmunitario a la presencia de la cubierta del virus o de su contenido representa una limitación importante a su potencial utilización de forma sistemática en la práctica clínica. El material genómico del virus, por ejemplo, activa la proteína TLR9, localizada en la membrana de determinadas células inmunitarias. TLR9 detecta específicamente ADN extraño para las células humanas y activa el desarrollo de una respuesta inmunitaria que acaba identificando al adenovirus asociado y puede comprometer la seguridad de la terapia y la salud del paciente.
Un estudio internacional dirigido por la Universidad de Harvard ha abordado este problema y presenta una estrategia que hace posible que la terapia génica con virus adenoasociados evada al sistema inmunitario.
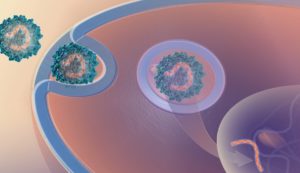
El equipo de investigadores ha incorporado al genoma de los virus adenoasociados un conjunto de secuencias cortas de ADN no codificante que ocultan el material hereditario del virus de la acción del sistema inmunitario. “Hipotetizamos que pequeños fragmentos de ADN que se unen e inhiben la activación de TLR9, incluyendo las secuencias de ADN de los extremos de los cromosomas, denominados telómeros, serían una forma de tapar el genoma del virus adenoasociado de este mecanismo de inmuno-vigilancia”, señala Ying Kai Chan, primer firmante del trabajo, investigador visitante en el Instituto Wyss de la Universidad de Harvard y director científico en Ally Therapeutics, empresa startup creada para desarrollar y comercializar productos dirigidos a evitar las barreras inmunitarias de la terapia génica.
Los investigadores han probado en diferentes modelos animales la efectividad de la “capa de invisibilidad” molecular conferida por los oligonucleótidos inhibidores de TLR9 integrados en el genoma viral. Tanto en ratón como en cerdo y en diferentes tejidos han observado que la terapia con virus adenoasociados con oligonucleótidos inhibidores produce una respuesta inmunitaria más reducida que la que se observa en el caso de los animales tratados con virus adenoasociados control.
Dentro de los tejidos analizados destaca el análisis que el equipo de investigadores ha realizado en el ojo. Este órgano se considera especialmente privilegiado a la hora de plantear una terapia génica, ya que existe una barrera hemato-retiniana que regula el movimiento de moléculas a la retina y limita la entrada de células inmunitarias y otros factores inmunológicos. Algunos estudios, sin embargo, han encontrado que al administrar dosis elevadas puede producirse inflamación, lo que indica que el ojo no es completamente ajeno a una respuesta inmunitaria frente a la terapia génica.
Al investigar la eficacia de los virus adenoasociados modificados como terapia génica en el ojo, los investigadores han obtenido resultados relevantes para el diseño de futuras terapias. Por una parte, en un modelo en cerdos encontraron que la administración subretinal de la terapia con virus adenoasociados diseñados para evadir el sistema inmunitaria conseguía evitar los efectos adversos que se observan al utilizar virus adenoasociados normales. Sin embargo, al utilizar un método de administración menos invasivo, como es una inyección en la cavidad vítrea, en un modelo en macaco, el equipo encontró que la integración de secuencias cortas en el genoma de los virus adenoasociados no conseguía evitar una respuesta inflamatoria. El tratamiento retrasaba la respuesta adversa pero no lo prevenía.
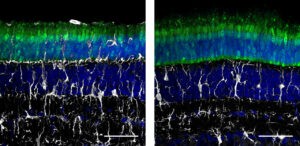
Aunque la vía intravítrea es más deseable debido a su carácter menos invasivo y a la capacidad para alcanzar un mayor número de células, no se suele utilizar en las terapias génicas debido a que genera una mayor respuesta inmunitaria. Dada la incapacidad de los virus adenoasociados modificados para evitar la acción del sistema inmunitario en este método de administración los investigadores sugieren que, además de TLR9, podría haber otros mecanismos inmunitarios implicados. “Los resultados de la toxicidad intravítrea inducida por virus adenoasociados, y la modesta respuesta a la secuencia que bloquea TLR9 y a los esteroides indican que hay más de un mecanismo influyendo en la toxicidad en este sitio de inyección”, señala Constance Cepko, profesora de Genética y Neurociencias en el Instituto Blavatnik de la Universidad de Harvard, investigadora en el Instituto de Medicina Howard Hughes y miembro del Instituto de Células Madre de Harvard, que ha participado en el estudio.
Los resultados del trabajo indican que es posible modular la respuesta inmunitaria frente a los componentes de las terapias génicas con virus adenoasociados. Los autores han detectado que la eficacia de la estrategia depende del modelo utilizado, lo que abre nuevas vías de investigación para mejorar una de las aproximaciones más prometedoras para el tratamiento de las enfermedades genéticas. “Toda nueva modalidad terapéutica que consigue un éxito inicial en la clínica tiene que pelear con problemas emergentes antes de ser implementada de forma amplia y la terapia génica con virus adenoasociados no es una excepción”, destaca Chan. “Nuestro trabajo representa un punto crítico en el desarrollo de la próxima generación de vectores de virus adenoasociados más seguros y efectivos”.
Referencia: Chan YK, et al. Engineering adeno-associated viral vectors to evade innate immune and inflammatory responses. Sci Transl Med. 2021. DOI: http://dx.doi.org/10.1126/scitranslmed.abd3438
Fuente: A new vision for AAV-delivered gene therapies. https://wyss.harvard.edu/news/a-new-vision-for-aav-delivered-gene-therapies/
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos y formación universitaria, así como nuestro canal audiovisual, Genotipia TV.




