Una herramienta genética para crear aneuploidías a la carta y analizar su impacto durante el desarrollo permite observar que las células aneuploides son activamente eliminadas por sus células vecinas mediante competición celular.
Más del 80 % de los embriones humanos tempranos contienen células con un número incorrecto de cromosomas, un fenómeno conocido como aneuploidía, y que deriva de no repartir correctamente los cromosomas durante las primeras divisiones celulares. Sorprendentemente, esos errores desaparecen antes de la implantación, y cuando no se eliminan correctamente, la aneuploidía causa abortos. Comprender cómo se determina qué células viven y cuáles mueren es clave para entender la fertilidad, y podría tener implicaciones también para enfermedades como el cáncer.
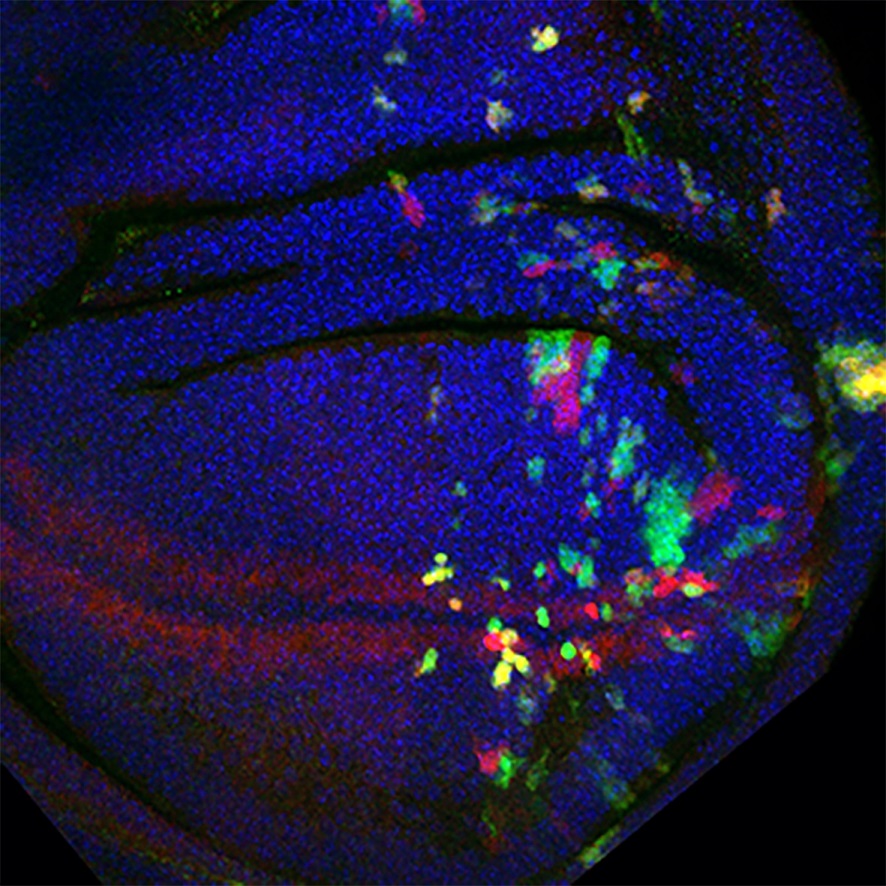
Un equipo del IRB Barcelona liderado por el Dr. Marco Milán ha desarrollado una herramienta que genera aneuploidías a la carta y marca las células portadoras de estas aneuploidías con precisión dentro de un tejido vivo, una ventana sin precedentes para observar el comportamiento de estas células en tiempo real.
El método, publicado en la revista Cell Genomics, funciona como una especie de “tijera molecular” que permite cambiar el número de copias de grandes regiones del genoma generando tanto monosomías (una sola copia), como trisomías (tres copias). “Podemos seleccionar qué pedazo del genoma queremos alterar y ver inmediatamente cómo responden las células”, explica el Dr. Milán. La herramienta se probó en tejidos epiteliales de la mosca Drosophila.
Una de las principales conclusiones del trabajo es la presencia en el genoma de un alto número de genes haploinsuficientes, genes que en una sola copia debilitan el crecimiento y la supervivencia de las células monosómicas. Además se ha observado que su eliminación se ve puede ver acelerada por competición celular con vecinas más aptas. La eliminación de las células aneuploides, por tanto, depende tanto del déficit génico interno como del entorno.
Cuando “falta una copia del manual de instrucciones”
Las células monosómicas pierden una de las dos dosis cromosómicas de decenas o centenas de genes clave. Muchos de estos genes son haploinsuficientes, es decir, con una sola copia ya no producen suficiente proteína para mantener la maquinaria celular a pleno rendimiento.
Entre los genes haploinsuficientes más conocidos figuran aquellos que codifican para proteínas ribosomales, piezas básicas de la fábrica de proteínas. Cuando una célula reduce de golpe la cantidad de una sola subunidad ribosomal, toda la producción se ralentiza y aumenta el estrés. Ese déficit la convierte en una “jugadora débil” dentro del tejido.
Gracias a uno de los dos sistemas desarrollados en este trabajo, que permite generar células monosómicas en un tejido normal, se ha demostrado que el genoma está poblado de un gran número de genes haploinsuficientes aparte de aquellos que codifican para proteínas ribosomales, y que las células monosómicas son eliminadas mediante diferentes mecanismos moleculares de competición celular.

Competición celular
Los experimentos muestran que las células monosómicas crecen más despacio, pero su destino final lo dictan las células de su entorno. Gracias al segundo sistema desarrollado en el trabajo, que permite generar células monosómicas y trisómicas a la vez en el mismo tejido, se vio que las celulas trisómicas pueden acelerar el proceso de eliminación de las células monosómicas. “Descubrimos que las células “más aptas” empujan literalmente a las aneuploides a la apoptosis; si las dejamos solas, pueden sobrevivir”, detalla la Dra. Elena Fusari, primera autora del estudio y beneficiaria de una beca de “la Caixa”.
Los resultados apuntan a que la propia interacción entre células es tan importante como la aneuploidía, una idea que abre la puerta a terapias que modifiquen el vecindario celular para forzar la eliminación de clones patológicos.
Consecuencias para la fertilidad y la oncología
Recrear este duelo celular ayuda a explicar por qué los embriones con altos niveles de aneuploidía suelen descartarse en los laboratorios de fecundación in vitro.
“En el campo de la fecundación asistida se está empezando a pensar que vale la pena reevaluar algunos criterios de selección, porque el propio embrión parece poder eliminar las células problemáticas”, señala la Dra. Fusari.
Al mismo tiempo, comprender las “reglas” de la competición celular entre células aneuploides abre vías para diseñar terapias que eliminen a las células cancerígenas, que también son aneuploides, de un tejido sano.
Próximos pasos para la herramienta que genera aneuploidías
Con la herramienta desarrollada, el equipo científico llevará a cabo una búsqueda exhaustiva de todas las regiones haploinsuficientes del genoma de Drosophila. “El objetivo es mapear qué genes activan las alarmas de competición y cómo podemos modular esa respuesta”, concluye el Dr. Milán.
A largo plazo, este conocimiento podría servir para aumentar la tasa de éxito de los tratamientos de reproducción asistida y para desarrollar fármacos que ataquen la aneuploidía, característica de muchos tumores.
El estudio contó con el apoyo de la Fundación “la Caixa”, el Ministerio de Ciencia e Innovación, fondos europeos FEDER y la Generalitat de Catalunya través del programa CERCA.
Artículo científicosFusari E, et al. Depletion of aneuploid cells is shaped by cell-to-cell interactions. Cell Genom. 2025 May 28:100894. doi: https://doi.org/10.1016/j.xgen.2025.100894