Consumo materno de fructosa, dieta occidental y virus SARS-CoV2
Elena Fauste, Cristina Donis, Madelín Pérez-Armas, Lourdes Rodríguez, Silvia Rodrigo, Juan José Álvarez-Millán1, Paola Otero, María Isabel Panadero y Carlos Bocos
Facultad de Farmacia, Universidad San Pablo-CEU, CEU Universities, Montepríncipe, Boadilla del Monte, 28668 Madrid, España. 1Laboratorios CQS, Rivas-Vaciamadrid, Madrid.
En las últimas décadas, los cambios producidos en la dieta junto con un estilo de vida sedentario han provocado un incremento en la prevalencia de obesidad, síndrome metabólico (MetS, del inglés Metabolic Syndrome), hígado graso no alcohólico (NAFLD, Non Alcoholic Fatty Liver Disease) y diabetes tipo 2 (T2DM, type 2 Diabetes mellitus) (Taskinen et al., 2019).
La fructosa es un monosacárido que se encuentra de forma natural en frutas, verduras y miel. Sin embargo, también está presente, como azúcar añadido, en alimentos procesados y bebidas azucaradas en forma de sacarosa y de jarabe de maíz rico en fructosa (HFCS, high-fructose corn syrup). Numerosos estudios científicos han puesto de manifiesto que las dietas ricas en fructosa favorecen la aparición de MetS, lo que aumenta el riesgo de desarrollar hipertensión, enfermedades cardiovasculares (ECV), T2DM, NAFLD, hiperuricemia, gota y enfermedad renal crónica (Zhang et al., 2017). De hecho, el término “enfermedad relacionada con los alimentos procesados” hace referencia a las enfermedades en las que la dieta es uno de los factores causales esenciales y en el que se incluyen T2DM, hipertensión, obesidad, cáncer, enfermedad cardiaca y hepática (Lustig, 2020).
Por otro lado, está bien establecido que los eventos metabólicos que tienen lugar durante el desarrollo pre y postnatal modulan el riesgo de desarrollar enfermedades metabólicas en la edad adulta (Koletzko et al., 2005), siendo la dieta materna uno de los factores más importantes (Vickers et al., 2005). De hecho, se ha demostrado que la ingesta materna de fructosa provoca muchas de las alteraciones características del MetS en la descendencia macho adulta (Rodríguez et al., 2016). Además, la ingesta materna de fructosa puede modular la respuesta de la progenie a la ingesta de fructosa cuando es adulta (Fauste et al., 2020). Sin embargo, a pesar de las múltiples evidencias científicas que sugieren una conexión entre el elevado consumo materno de bebidas que contienen fructosa y la epidemia mundial de obesidad y MetS (Rodríguez et al., 2013; Vilà et al., 2011), la ingesta de bebidas y/o alimentos enriquecidos con fructosa continúa sin estar contraindicada durante la gestación.
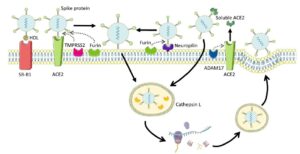
La COVID-19 es una enfermedad respiratoria provocada por el coronavirus-2 del síndrome respiratorio agudo severo (SARS-CoV2) y que ha alcanzado el estado de pandemia. La entrada habitual del SARS-CoV-2 en la célula huésped (“vía canónica”) se produce mediante la unión al receptor, localizado en la superficie celular, de la enzima convertidora de angiotensina 2 (ACE2, angiotensin-converting enzyme 2). A continuación, la proteasa transmembrana serina 2 (TMPRSS2, transmembrane protease, serine 2) escinde la proteína viral Spike (S, espícula), lo que permite la fusión de las membranas celular y viral. Sin embargo, dado que la expresión de estas dos moléculas es insignificante en muchos tejidos, es necesario reconsiderar la posibilidad de que el virus entre en los tejidos por otras vías menos habituales. Así pues, estas vías alternativas (denominadas “no canónicas”) implicarían a otras proteasas, como la catepsina L, la metaloproteasa 17 (ADAM17) o la furina (Coate et al., 2020), así como a otros posibles receptores, como la neuropilina-1 (Daly et al., 2020) o el receptor Scavenger clase B tipo 1 (SRB1) (Wei et al., 2020). La neuropilina se ha descrito como un receptor alternativo a ACE2 para la entrada viral y, además, se ha visto que está asistida por la furina.
Figura 1. Receptores y proteasas de la superficie celular que permiten y facilitan la entrada de SARS-CoV-2 a la célula. Esta imagen ha sido creada usando Servier Medical Art (https://smart.servier.com).
Aunque la COVID-19 afecta a todos los grupos de población, se ha visto que tanto la gravedad de la patología como la mortalidad son desproporcionadamente más elevadas en los ancianos y/o en aquellos pacientes con afecciones subyacentes, como T2DM, obesidad, ECV y otras enfermedades crónicas (Coate et al., 2020). Además, dado que se ha demostrado que la dieta occidental contribuye al desarrollo de estas enfermedades metabólicas, los alimentos procesados ricos en fructosa, las bebidas azucaradas y las dietas ricas en grasas y/o colesterol podrían aumentar el riesgo de estos grupos de población de padecer una patología COVID-19 grave y elevar la mortalidad de la misma (Butler & Barrientos, 2020).
Para demostrar nuestra hipótesis y dilucidar los mecanismos implicados, hemos utilizado nuestro modelo de rata de programación fetal provocada por la ingesta materna de fructosa en el que aparecen en la progenie características típicas del MetS, directamente o después de la suplementación con fructosa (Rodríguez et al., 2016; Fauste et al., 2020; Rodríguez et al., 2013). Este modelo animal de síndrome metabólico ha sido utilizado previamente por nosotros y otros investigadores para demostrar que la ingesta materna de fructosa induce claros desajustes metabólicos en la progenie con posibles implicaciones clínicas (Rodríguez et al., 2016). Además, diversos artículos sobre la fisiopatología de la infección por SARSCoV-2 en personas con diabetes, ECV y obesidad, han indicado que el tracto gastrointestinal, el hígado, los islotes y el tejido adiposo también se ven afectados, lo que genera incertidumbre sobre su posible implicación en la gravedad de la COVID-19 (Drucker, 2021).
Así, en el presente estudio investigamos, por un lado, si el consumo de fructosa sola o como parte de una dieta occidental afecta la expresión génica en hígado y en intestino delgado de las proteínas que permiten y potencian la entrada del SARS-CoV2 a la célula y, por otro, si todo ello pudiera estar influenciado por la ingesta materna de fructosa. Para ello, la fructosa se suministró a ratas preñadas en el agua de bebida y, posteriormente, se estudiaron los descendientes tras consumir agua, fructosa líquida sola o como parte de una dieta occidental (fructosa más colesterol). Además, para asegurarnos que los efectos observados eran específicos de la fructosa, se utilizó otro grupo experimental que tomó tagatosa (un epímero de la fructosa).
Curiosamente, tanto el consumo materno de fructosa como la ingesta directa de la misma por los propios descendientes no afectaron a la expresión génica hepática de los factores implicados en la entrada del virus a la célula.
Sin embargo, como se ha mencionado anteriormente, también se llevaron a cabo estudios en íleon. En este caso, aunque la vía clásica de entrada del virus (ACE2 y TMPRS2) no presentó cambios significativos, la expresión génica de las proteínas de la vía “no canónica” sí que se vio claramente afectada. Así, la expresión génica de las proteasas (ADAM17 y catepsina L) experimentó un incremento significativo tras el consumo de fructosa; y el receptor SRB1, que se ha demostrado que colabora con ACE2 para facilitar la entrada de SARSCoV-2 a la célula (Wei et al., 2020), también mostró un claro aumento inducido por la fructosa. Es más, el receptor neuropilina-1 también aumentó su expresión en respuesta a la ingesta de la fructosa en los descendientes de madres control.
Sorprendentemente, no se observaron esos cambios promovidos por la fructosa en los descendientes de madres que consumieron fructosa durante la gestación. Estos hallazgos, junto con la falta de efecto de la fructosa en el hígado, indicarían que el consumo materno de fructosa podría proteger en cierto modo de la entrada viral a la célula. Sin embargo, se observó todo lo contrario cuando los descendientes recibieron una dieta occidental. La ingesta materna de fructosa exacerbó los efectos perjudiciales inducidos por el consumo conjunto de fructosa y colesterol, viéndose aumentada la expresión génica de proteasas de la vía no canónica (catepsina y ADAM17), así como del receptor alternativo a ACE2 (neuropilina) y el receptor que colabora con ACE2 (SRB1). Estos hallazgos estarían en concordancia con aquellos estudios en humanos que muestran que los pacientes con estadios avanzados de NAFLD muestran una mayor expresión de los factores de entrada del SARS-CoV-2 y, por lo tanto, un mayor riesgo de progresión de la enfermedad que los pacientes sin estas enfermedades metabólicas (Fondevila et al., 2021).
Por otro lado, nuestras publicaciones anteriores revelan la importancia de estudiar los efectos de la fructosa en comparación con otros edulcorantes, para estar seguros de que los efectos provocados por la fructosa son específicos de este carbohidrato. Por esta razón, en el presente estudio utilizamos la tagatosa, un epímero de la fructosa que se utiliza cada vez más como azúcar alternativo bajo en calorías y que mejora el control glucémico en personas con y sin diabetes (Noronha et al., 2018). De hecho, se ha demostrado que el consumo excesivo crónico de tagatosa no induce los mismos trastornos metabólicos que se observan tras la administración de fructosa (Collotta et al., 2018).
En el presente estudio encontramos que la expresión génica hepática de la mayoría de los factores no experimentó cambios significativos en respuesta a este azúcar, al igual que lo observado con la fructosa, salvo para la expresión de TMPRS22 que sí se vio incrementada. Este hecho es llamativo dado que se ha propuesto que los bajos niveles de esta proteasa encontrados en lactantes y niños son una de las razones de su mayor protección contra la enfermedad COVID19 (Schuler et al., 2021). De hecho, se ha demostrado que la expresión de TMPRSS2 en ratones y humanos aumenta con la edad, lo cual se correlaciona con el hecho de que hay una mayor propensión a la infección por COVID 19 a edades avanzadas. Curiosamente, el consumo de tagatosa hizo que la expresión en íleon de los genes ACE2 y TMPRSS2 (la vía “canónica”) se viera aumentada de manera significativa en los descendientes de madres-fructosa, pero no en los provenientes de madres control. Estos resultados deberían hacernos reconsiderar la posibilidad de reducir o evitar el enorme uso de carbohidratos como componentes de una gran variedad de alimentos como edulcorantes y conservantes.
Así pues, aunque en el presente estudio apenas se observaron efectos en el hígado, la ingesta materna de fructosa sí que potenció el aumento inducido por la dieta occidental en la expresión de factores de entrada del SARS-CoV2 en el íleon de los descendientes. Por tanto, la descendencia de madres-fructosa resultaría más propensa al desarrollo de esta patología de origen viral que la progenie de gestantes que no consumieron fructosa.
Lo más relevante del presente estudio es que, aunque nosotros no hemos medido directamente la entrada del SARS-CoV2 en las células, recientemente se ha demostrado que los niveles de proteínas de los factores clave para la entrada viral coinciden con los niveles de ARN mensajero (como los medidos en el presente trabajo) y que, además, son un reflejo directo de la susceptibilidad de las células a la infección por SARS-CoV2. Finalmente, con las limitaciones evidentes de extrapolar los resultados encontrados en el modelo animal al ser humano, y dado que no se han realizado determinaciones en otros tejidos susceptibles a la infección por SARS-CoV2 como son pulmón, suero y tejido adiposo, para confirmar la aplicabilidad de los hallazgos aquí descritos sería necesario extender en el futuro las determinaciones del presente estudio a otros tejidos y modelos de experimentación.
En resumen, hemos demostrado que la ingesta materna de fructosa proporciona, en principio, cierta protección frente a la infección por SARS-CoV-2 a la descendencia. Sin embargo, uno de los resultados más destacados es que la ingesta materna de fructosa exacerba la expresión génica en intestino delgado de los factores de entrada del virus cuando su descendencia consume fructosa y colesterol (dieta occidental). Así pues, teniendo en cuenta la posible implicación del consumo de alimentos procesados y bebidas ricas en fructosa en el desarrollo de muchas enfermedades comunes no transmisibles como, por ejemplo, la aterosclerosis, el síndrome metabólico y la diabetes, entre otras, y la relación cada vez más evidente con la enfermedad COVID, es necesario promover el consumo de dietas saludables que impliquen una reducción de la ingesta de este tipo de alimentos y bebidas, especialmente durante la gestación.
Artículo original: Fauste, E., Donis, C., Pérez-Armas, M., Rodríguez, L., Rodrigo, S., Álvarez-Millán, J. J., Otero, P., Panadero, M. I. & Bocos, C. (2023). Maternal fructose boosts the effects of a Western-type diet increasing SARS-COV-2 cell entry factors in male offspring. Journal of Functional Foods, 100, 105366. https://doi.org/10.1016/j.jff.2022.105366
Bibliografía:
Butler, M. J., & Barrientos, R. M.. The impact of nutrition on COVID-19 susceptibility and long-term consequences. Brain, Behavior, and Immunity, 87, 53–54. 2020. DOI: https://doi.org/10.1016/j.bbi.2020.04.040
Coate, K. C., et al. SARS-CoV-2 cell entry factors ACE2 and TMPRSS2 are expressed in the microvasculature and ducts of human pancreas but are not enriched in β cells. Cell metabolism, 32(6). 2020. 1028–1040. e1024.
Collotta, D., et al. Reduced susceptibility to sugar-induced metabolic derangements and impairments of myocardial redox signaling in mice chronically fed with D-tagatose when compared to fructose. Oxidative medicine and cellular longevity. 2018. Article 5042428.
Daly, J. L., et al. Neuropilin-1 is a host factor for SARS-CoV-2 infection. Science, 370(6518), 861–865. 2020. DOI: https://doi.org/10.1126/science.abd3072
Fauste, E., et al. FGF21-protection against fructose-induced lipid accretion and oxidative stress is influenced by maternal nutrition in male progeny. Journal of Functional Foods, 64. 2020. Article 103676.
Fondevila, M. F., et al. Obese patients with NASH have increased hepatic expression of SARS-CoV-2 critical entry points. Journal of Hepatology, 74(2), 469–471. 2021. DOI: https://doi.org/10.1016/j.jhep.2020.09.027
Koletzko, B., et al. Protein intake in the first year of life: a risk factor for later obesity? The E.U. childhood obesity project. Advances in Experimental Medicine and Biology, 569, 69–79. 2005. DOI: https://doi.org/10.1007/1-4020-3535-7_12
Lustig, R. H. Ultraprocessed food: Addictive, toxic, and ready for regulation. Nutrients, 12(11). 2020. DOI: https://doi.org/10.3390/nu12113401
Noronha, J. C., et al. The effect of small doses of fructose and its epimers on glycemic control: A systematic review and meta-analysis of controlled feeding trials. Nutrients, 10(11). 2018. DOI: https://doi.org/10.3390/nu10111805
Rodríguez, L., et al. Fructose during pregnancy affects maternal and fetal leptin signaling. The Journal of Nutritional Biochemistry, 24(10), 1709–1716. 2013. DOI: https://doi.org/10.1016/j.jnutbio.2013.02.011
Rodríguez, L., et al. Fructose only in pregnancy provokes hyperinsulinemia, hypoadiponectinemia, and impaired insulin signaling in adult male, but not female, progeny. European Journal of Nutrition, 55(2), 665–674. 2016. DOI: https://doi.org/10.1007/s00394-015-0886-1
Schuler, B. A., et al. Age-determined expression of priming protease TMPRSS2 and localization of SARS-CoV-2 in lung epithelium. The Journal of Clinical Investigation, 131(1). 2021. DOI: https://doi.org/10.1172/JCI140766
Taskinen, M. R., et al. Dietary fructose and the metabolic syndrome. Nutrients, 11(9). 2019. DOI: https://doi.org/10.3390/nu11091987
Vickers, M. H., et al. Neonatal leptin treatment reverses developmental programming. Endocrinology, 146(10), 4211–4216. 2005. DOI: https://doi.org/10.1210/en.2005-0581
Vilà, L., et al. Liver AMP/ATP ratio and fructokinase expression are related to gender differences in AMPK activity and glucose intolerance in rats ingesting liquid fructose. The Journal of Nutritional Biochemistry, 22(8), 741–751. 2011. DOI: https://doi.org/10.1016/j.jnutbio.2010.06.005
Wei, C., et al. HDLscavenger receptor B type 1 facilitates SARS-CoV-2 entry. Nat Metab, 2(12), 1391–1400. 2020. DOI: https://doi.org/10.1038/s42255-020-00324-0
Zhang, D. M., et al. High dietary fructose: Direct or indirect dangerous factors disturbing tissue and organ functions. Nutrients, 9(4). 2017. DOI: https://doi.org/10.3390/nu9040335
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos, como el de «Nutrición de precisión«, y formación universitaria, así como nuestro canal audiovisual, Genotipia TV.



