Un mapa epigenético del origen del cáncer de páncreas
 IRB Barcelona
IRB Barcelona
- Las células con mayor capacidad para formar tumores se caracterizan por tener estados epigenéticos aberrantes que les permiten una mayor comunicación con células de su entorno.
- Realizado en ratones, el estudio describe las bases moleculares de la plasticidad celular responsable del inicio de la tumorigénesis inducida el oncogén KRAS e inflamación tisular, y abre vías a nuevos enfoques terapéuticos.
- El trabajo ha sido publicado en Science y coliderado por la Dra. Direna Alonso-Curbelo del IRB Barcelona junto a investigadores del Memorial Sloan Kettering Cancer Center de Nueva York.
Las mutaciones en el ADN son causas conocidas y bien estudiadas del cáncer. En concreto, mutaciones en el oncogén KRAS son frecuentes en el cáncer de pulmón, el cáncer colorrectal y el cáncer de páncreas. Sin embargo, las mutaciones sólo explican una parte del desarrollo de la enfermedad.
Según un estudio publicado en la revista Science por investigadores del Memorial Sloan Ketterin Cancer Center (MSKCC), de Nueva York, y la Dra. Direna Alonso-Curbelo, del Instituto de Investigación Biomédica IRB Barcelona, las interacciones entre las mutaciones genéticas y otros factores externos como, por ejemplo, una lesión tisular que provoque inflamación, modifican la identidad de las células como su entorno local y favorecen la aparición y progresión de tumores.
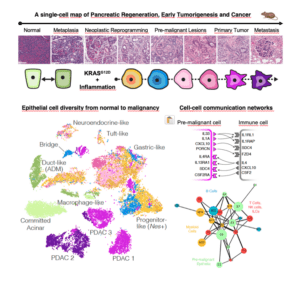
En el cáncer de páncreas, estos cambios empiezan a producirse rápidamente, entre 24 y 48 horas después de un daño tisular, y ocurren de forma predecible. Como consecuencia, la capacidad de algunas células con KRAS mutante para comunicarse e interactuar con otras células de su entorno aumenta enormemente. Estos son los resultados de un nuevo estudio publicado en Science que combinó sofisticados modelos de ratón genéticamente modificados y métodos computacionales avanzados para mapear los distintos estados celulares que conducen al desarrollo del adenocarcinoma ductal pancreático (PDAC), el tipo más común de cáncer de páncreas.
Aunque la tasa de supervivencia a cinco años del cáncer de páncreas ha aumentado en los últimos años, sigue siendo muy baja, entorno al 12%, según la Pancreatic Cancer Action Network. La enfermedad no suele detectarse hasta que el cáncer se encuentra en fases avanzadas y, gracias en parte a los avances en el tratamiento de otros tipos tumorales, el cáncer de páncreas es a día de hoy la tercera causa de muerte por cáncer.
El objetivo de la investigación era, por una parte, arrojar luz sobre los acontecimientos celulares tempranos difíciles de estudiar que dan lugar al cáncer de páncreas para encontrar posibles oportunidades de intervención médica en fases más tempranas de la enfermedad.

Cómo la plasticidad celular impulsa el cáncer
La capacidad de las células para desprenderse de su identidad original y adaptarse se denomina plasticidad. El equipo investigador descubrió que la inflamación potencia esta plasticidad.
«Estas células precancerosas adquieren la capacidad de enviar y recibir muchas más señales que una célula normal», explica la doctora en biología computacional Dana Pe’er, una de los dos autores principales del estudio. «Y vimos que esto no es aleatorio: está estructurado. Se observan los mismos patrones una y otra vez cuando se realizan los experimentos en diferentes ratones».
El estudio fue liderado por las coprimeras autoras Cassandra Burdziak, estudiante de doctorado en el laboratorio de la Dra. Pe’er (MSKCC), y la Dra. Direna Alonso-Curbelo, anteriormente investigadora del laboratorio del coautor principal el Dr. Scott Lowe (MSKCC) que ahora dirige su propio laboratorio en el IRB Barcelona.
Con el fin de estudiar los orígenes y los impactos de la plasticidad en las células que tienen una mutación en el gen KRAS, los científicos realizaron análisis de célula única en tejidos normales, inflamados, premalignos y malignos utilizando modelos de ratón genéticamente que recapitulan con precisión muchos aspectos del cáncer de páncreas en humanos – desde su inicio hasta la metástasis.
«Estos modelos nos permitieron captar los cambios más tempranos en las células epiteliales pancreáticas a medida que se reprograman de un estado sano a un estado maligno», explica el Dr. Lowe, investigador del Instituto Médico Howard Hughes y director del Programa de Biología y Genética del Cáncer del Memorial Sloan Kettering Cancer Center (MKSCC) de Nueva York.
Los análisis unicelulares permitieron a los investigadores desentrañar las características de las subpoblaciones de células individuales del páncreas en cada fase de la progresión y cómo sus interacciones impulsan aún más la progresión.
«Este proyecto requirió una cantidad significativa de innovación experimental y computacional», señala la Dra. Pe’er, que también es investigadora del Instituto Médico Howard Hughes y directora del Programa de Biología Computacional y de Sistemas del MSKCC. «Tuvimos que inventar una serie de métodos nuevos para responder a preguntas que no se suelen plantear sobre plasticidad, comunicación célula a célula y progresión tumoral».
Por ejemplo, el equipo inventó un nuevo método computacional para medir la plasticidad de una célula. El equipo también descubrió un aumento de la plasticidad durante el proceso de transformación tumoral que conduce a la activación de genes relacionados con la comunicación celular, como los que codifican ligandos y receptores.
«Básicamente, estos genes permiten a las células enviar y recibir señales específicas de su entorno y comunicarse con otras células», explica la Dra. Pe’er. «Esto da a la célula la capacidad de responder a señales que una célula normal no podría. También tienen una mayor capacidad para comunicarse con las células inmunitarias y, como resultado, el sistema inmunitario que rodea a estas células empieza a cambiar.»
Además, los investigadores pudieron identificar subpoblaciones de células premalignas, algunas de ellas bastante raras, que se convierten en importantes “núcleos de comunicación”, impulsando un bucle de retroalimentación que favorece la aparición y progresión del tumor.
El estudio representa la culminación de investigación iniciada por la Dra. Alonso-Curbelo, interesada en detallar el mecanismo molecular por cual la inflamación favorece la iniciación del cáncer. «Este trabajo fue posible gracias a una sinergia entre ciencia experimental y ciencia computacional», afirma la Dra. Alonso-Curbelo.
El equipo validó las predicciones computacionales mediante distintas técnicas experimentales innovadoras. «Por ejemplo, técnicas de imágenes nos mostraron que las poblaciones de células que, según los métodos computacionales, hablaban entre sí estaban mucho más cerca unas de otras en el tejido», explica Burdziak, bióloga computacional.
Mediante experimentos funcionales adicionales, el equipo pudo demostrar que estas conversaciones intercelulares impulsan el desarrollo del cáncer. «Desarrollamos nuevos modelos genéticos para bloquear específicamente la comunicación célula-célula asociada a la plasticidad neoplásica», afirma la Dra. Alonso-Curbelo, jefa del laboratorio de Inflamación, Plasticidad Tisular y Cáncer del IRB Barcelona. «Estos análisis demostraron que estas redes de comunicación expansivas que se establecen en las fases iniciales del cáncer de páncreas son funcionalmente relevantes y dirigen el proceso de tumorigénesis en ratones».
Un camino hacia nuevas vías terapéuticas
En conjunto, la investigación ofrece una nueva visión, en alta resolución, de cómo células portadoras de una copia mutada del gen KRAS y sometidas a inflamación adquieren plasticidad e impulsan la progresión del cáncer.
«Esto proporciona una nueva hoja de ruta que puede ayudar a desarrollar estrategias para detectar o incluso prevenir tumores pancreáticos antes de que alcancen fases avanzadas», afirma el Dr. Lowe. “Comprender cómo las redes de comunicación entre células impulsan el inicio del cáncer de páncreas es prometedor para el desarrollo de terapias que bloqueen o ralenticen la progresión temprana del cáncer, e incluso potencialmente la enfermedad más avanzada.»
“Desvelar las características moleculares que definen a las células con mayor plasticidad y capacidad para transformarse en respuesta a mutaciones genéticas o señales del entorno es un paso fundamental para entender e interceptar los orígenes del cáncer”, indica la Dra. Alonso-Curbelo.
Este trabajo ha sido financiado con ayudas del “Alan and Sandra Gerry Metastasis and Tumor Ecosystems Center” del MSKCC, el NCI (P30 CA008748, F31CA24690, U54 CA209975), la beca Postdoctoral Junior Leader de la Fundación La Caixa (LCF/BQ/PI20/11760006), la fundación FERO (II Ayuda FERO-ASEICA), el Ministerio de Ciencia e Innovación de España (PID2021-128102OA-I00), la Fundación Dieter Morszeck, Fraser Memorial Trust, McGill MI4 Platform, Howard Hughes Medical Institute, the National Institutes of Health (R25 CA233208), la fundación Geoffrey Beene, y ayudas del National Institute of Child Health and Human Development (HD084071) y el Starr Cancer Consortium.
Artículo científico: Burdziak C. et al. Epigenetic plasticity cooperates with cell-cell interactions to direct pancreatic tumorigenesis. Science (2022) DOI: http://dx.doi.org/10.1126/science.add5327
Si te ha gustado esta noticia y quieres aprender más sobre Genética en Medicina, te interesan nuestros cursos, como el de “Oncología de Precisión” o “Medicina Genómica en Oncología y sus aplicaciones clínicas“ o el de «Epigenética en medicina«, y formación universitaria, así como nuestro canal audiovisual, Genotipia TV.